Principio de Pauli
El principio de Pauli -también conocido como "prohibición de Pauli" o "principio de exclusión de Pauli"- es una ley de la física, o más concretamente del campo de la física cuántica. El descubrimiento del principio de Pauli se remonta al científico austriaco Wolfgang Ernst Pauli, que formuló uno de los principios más fundamentales de la mecánica cuántica en 1925.
Un pequeño recordatorio: la mecánica cuántica se ocupa de las leyes y estados de la materia y de cómo pueden calcularse sus propiedades físicas (en el rango de tamaño de los átomos e inferior). Esto hace que el principio de Pauli sea especialmente relevante para la química.Principio de Pauli: definición
Básicamente, la definición del principio de Pauli va más allá de las estandarizaciones que se aplican en la física clásica. Se basa en la suposición de que es imposible determinar en cualquier momento si dos partículas de un átomo se encuentran en el mismo lugar o no. La consecuencia lógica es que inicialmente son indistinguibles. Como han demostrado los experimentos, se puede determinar una cierta probabilidad para los orbitales (áreas extendidas con varias partículas) con el fin de calcular dónde se encuentran los electrones en ellos. En ocasiones, las zonas se solapan, de modo que las partículas también pueden estar en el mismo lugar.
Aquí es donde entra en juego el principio de Pauli de la física: dos electrones nunca pueden tener los mismos números cuánticos. Estas variables medidas para las propiedades de movimiento de un electrón proporcionan información sobre el orbital, el momento angular y el espín. El principio de Pauli estipula que dos electrones deben diferir al menos en uno de sus números cuánticos. Por tanto, se aplica a todas las partículas con espín semientero, conocidas como fermiones. Además de los electrones, esto incluye también a los protones y neutrones.
Sin embargo, los llamados bosones, responsables de la transmisión de fuerzas, no están sujetos al principio de Pauli. Forma general:La función de onda total de 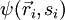 de un sistema de n fermioneses totalmente antisimétrica con respecto al intercambio de dos partículas:
de un sistema de n fermioneses totalmente antisimétrica con respecto al intercambio de dos partículas: 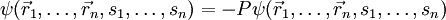
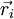 son la ubicación y si de la orientación de espín del i-ten fermión. Además, P es el operador de permutación que hace que dos partículas se intercambien, dando lugar a la fórmula:
son la ubicación y si de la orientación de espín del i-ten fermión. Además, P es el operador de permutación que hace que dos partículas se intercambien, dando lugar a la fórmula:
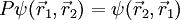 .
. La consecuencia del principio de Pauli
Al caracterizar los fermiones mediante el principio de Pauli, puede demostrarse que sólo dos electrones pueden situarse alguna vez en un orbital fuera del núcleo atómico. Desde la perspectiva actual, esto significa que cuando se intercambian fermiones idénticos, la función de onda de un sistema cuántico se vuelve antisimétrica. Esto permite extraer conclusiones precisas sobre la estructura y diferenciación (tabla periódica) de la materia. Además, la interacción de intercambio de electrones, que define el principio de Pauli, es responsable del magnetismo.
Interpretación exacta de la regla de Pauli
La antisimetría total de una función de onda significa que cambia de signo cuando se intercambian dos partículas cualesquiera. En física, la antisimetría significa que dos fermiones nunca pueden ocupar el mismo estado cuántico: Si dos fermiones coinciden en ubicación y número cuántico de espín, un intercambio formal de los dos fermiones no cambia la función de onda, debido a su indistinguibilidad. La única solución es entonces una función de onda total evanescente porque Ψ = − Ψ, es decir Ψ = 0.
En el caso de una separación en función de onda local y función de onda de espín, la antisimetría de la función de onda total requiere una función de onda de espín antisimétrica para una función de onda local simétrica, y viceversa. Una función de onda de espín (anti)simétrica caracteriza una orientación de espín (anti)paralela por pares. La solución trivial de una función de onda espacial antisimétrica se obtiene si las partículas elementales intercambiadas por pares se encuentran en el mismo lugar (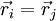 ) .
) .
 Miles de productos en stock
Miles de productos en stock